Articles
- Page Path
- HOME > J Mov Disord > Volume 1(1); 2008 > Article
-
Review Article
Transcranial Sonography in Parkinson’s Disease and Parkinsonism - Won Yong Lee, Ji Youn Kim, Seong Tae Kima
-
Journal of Movement Disorders 2008;1(1):6-12.
DOI: https://doi.org/10.14802/jmd.08002
Published online: April 30, 2008
- Address for correspondence: Won Wong Lee, MD, PhD Department of Neurology, Samsung Medical Center, Sungkyunkwan University School of Medicine, 50 Ilw on-dong, Gangnam-gu, Seoul, 135-710, Korea Tel: +82-2-3410-3593, 3599, Fax: +82-2-3410-0052, E-mail: neurolwy@ skku.edu
Copyright © 2008 The Korean Movement Disorder Society
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
- 11,526 Views
- 321 Download
- 1 Crossref
ABSTRACT
- Transcranial sonography (TCS) is potentially useful for the diagnosis of Parkinson’s disease (PD). It is attractive because it is non-invasive, easily accessible and low risk test. So far, up to twenties of TCS studies in Parkinson’s disease and parkinsonism have been reported. However, studies on TCS have been restricted to European populations and no such study has been performed in Asian especially Korean population. To investigate the efficacy of TCS in Korean PD patients and its correlation with the clinical features, we carried out midbrain TCS in PD patients and normal controls, and evaluated the area of the substantia nigra (SN) hyperechogenicity and its ratio to the area of the whole m idbrain. According to our study, we could conclude that midbrain TCS is an effective diagnostic tool for detecting PD in the Korean population. In this review, we additionally summarized clinical application of TCS in differential diagnosis of atypical parkinsonism as well as restless leg syndrome and depression. Journal of Movement Disorders 1(1):6-12, 2008
- 신경과 영역에서 전산화 단층촬영(CT) 및 자기공명영상술(MRI)과 같은 영상진단 방법이 발달하면서 중추신경 내의 여러 해부학적 구조물의 이상을 진단하는데 많은 도움을 받고 있다. 그러나, 파킨슨병(Parkinson’s disease; PD)의 경우 중뇌(midbrain) 내의 흑질(substantia nigra)에 분명한 병리학적 병변이 있음에도 불구하고 CT나 MRI같은 기존의 영상진단으로는 그 이상을 확인할 수 없다. CT나 MRI 같은 기존의 영상진단으로는 뇌혈관장애, 수두증(hydrocephalus), 석회화와 같은 이차성 파킨슨증후군이나 일부 이형 파킨슨증후군(atypical parkinsonism)을 감별 진단하는데 도움을 받을 뿐이다.
- 이와는 반대로 핵의학검사에 해당하는 SPECT나 PET 검사를 이용하여 도파민 형성에 작용하거나(fluoro-dopa), 도파민 운반체(dopamine transporter)에 작용하는 리간드(ligand)를 이용하여 도파민 신경세포를 조영하는 방법으로 감별진단이나 병의 진행정도를 파악할 수 있다. 하지만 SPECT, PET 검사는 기계의 사용이 제한적이고 특히 파킨슨병 진단 및 감별에 필요한 리간드는 국내에서 사용이 거의 불가능한 실정이다.
- 1980년도 말에 경두개 초음파(transcranial sonography; 이하 TCS로 표기)가 신경계 질환에 도입되면서 뇌혈관 질환의 진단에 도움이 될 뿐 아니라 뇌실질(brain parenchyma)의 변화를 관찰하는 것이 가능해지기 시작했다. 1995년 독일의 신경과 의사인 Becker 등이 transcranial color coded duplex sonography를 이용하여 파킨슨병 환자에서의 흑질의 반향성(echogenicity)이 증가되어 있는 소견을 보고하였다.1 이 연구에서 정상 대조군에 비해 현저하게 반향성이 증가된 소견을 관찰하였다고 보고하면서 이는 흑질 내의 철분성분의 차이에 의해 나타나는 것으로 해석하였다. PD 환자에서의 이러한 소견은 정량적(quantitative) 분석 및 반정량적(semiquantitative) 분석을 통해 시험자 간에 비교적 적은 오차의 소견을 보여 피험자간 상호관계(interrater correlation) 수치가 0.8로 높은 소견을 보였다.2 이후 여러 연구자들의 TCS 연구를 통해서 약 91-100%의 파킨슨병 환자에서 중뇌에 hyperechogenicity 소견을 관찰하였다고 보고하였다.3-8 뿐만 아니라 이형 파킨슨증후군 환자에서도 TCS를 시행하여 PD와의 감별진단에 도움이 되는지를 관찰하는 연구도 다수 진행되었다.9-11
- 이러한 다양한 TCS 연구결과를 통해 TCS가 파킨슨병 감별진단에 있어 저렴하고, 안전하며, 쉽게 시행할 수 있는 진단 방법으로 발전되어 온 것은 부인할 수 없는 사실이다. 그러나 다른 연구자에 의해 제시되고 있는 부정적인 측면도 무시할 수는 없는 실정이다. 이러한 측면 중 하나가 TCS 연구에 있어서 대상 환자군이 이미 임상적 진단기준에 합당한 환자군이라는 사실이다. 즉 임상진단이 어려운 초기 환자에서는 TCS가 도움이 되지 않는다는 관점이다. 둘째로 TCS를 시행함에 있어 환자의 증상을 검사자가 볼 수밖에 없기 때문에 진정한 맹검(blind study)가 될 수 없다는 지적이다. 이런 이유 때문에 Prestel 등은 얼굴과 상체 전체를 보자기로 덮고 TCS probe만 접근할 수 있도록 구멍을 만들어 검사를 하는 웃지 못 할 방법도 시행하였다.12 셋째로 8-10%에 달하는 정상군에서 흑질의 hyperechogenicity가 관찰된다는 점이다.2,4 이 수치는 정상인이 PD로 발전할 수 있는 가능성보다는 매우 높은 수치로서 가양성(false positive)에 해당한다. 마지막으로 비록 유럽 내 여러 연구에서는 검사자간의 오차가 적은 것으로 보고되고 있지만,2 이 연구는 극히 유럽 인구에 국한되어 있으며 아시아인 특히 한국인에 대한 TCS 연구는 없는 실정이다. 즉 TCS 검사가 아시아인 특히 한국인 파킨슨병 환자의 진단에도 도움이 될지는 불확실하다.
- 이러한 이유 때문에 본 저자들은 국내 한국인 파킨슨병 환자와 정상인에게 TCS를 시행하여 TCS 검사의 유용성을 분석하고 환자의 임상지표 및 임상양상에 따른 TCS의 echogenicity의 차이를 분석하였다. 본 종설에서 먼저 파킨슨병 환자에서의 TCS 연구 방법 및 기존 연구결과를 제시하고, 한국인을 대상으로 한 본 저자의 연구 결과를 제시하고자 한다. 또한 파킨슨병 환자에 대한 연구뿐 아니라 이형 파킨슨증후군(atypical parkinsonism), 혈관성 파킨슨증후군(vascular parkinsonism)과의 감별진단과 근긴장이상증(dystonia), 파킨슨병에 동반되는 우울증, 하지불안증(restless leg syndrome) 및 overactive bladder (OAB)와 같은 자율신경장애 영역에서의 TCS 연구결과들도 고찰하고자 한다.
서 론
- 1. 파킨슨병 영역에서의 경두개 초음파검사
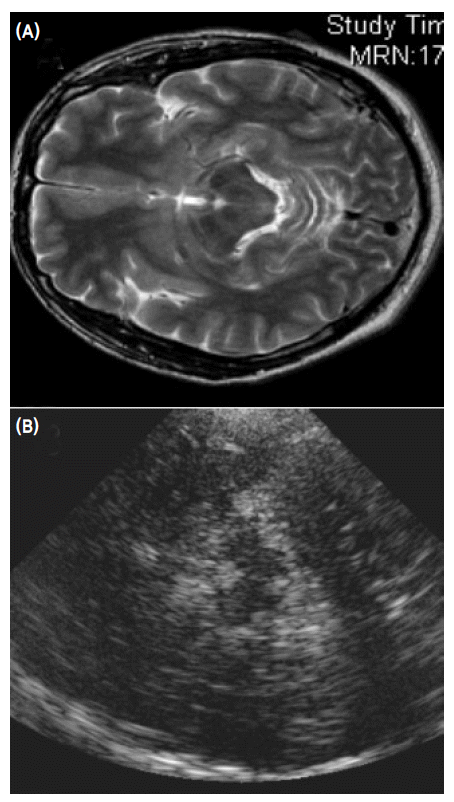
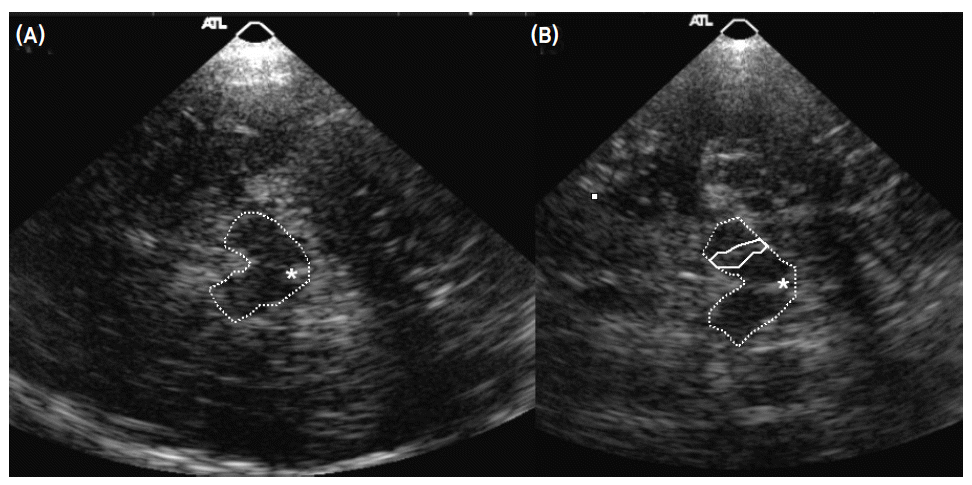
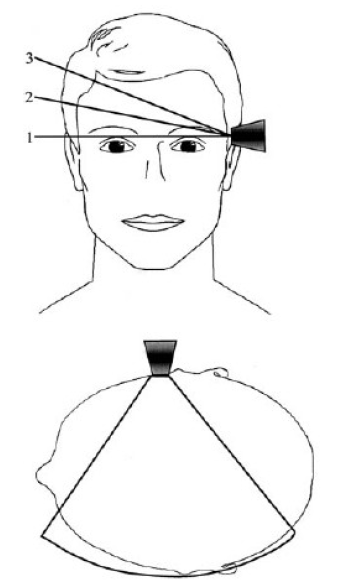
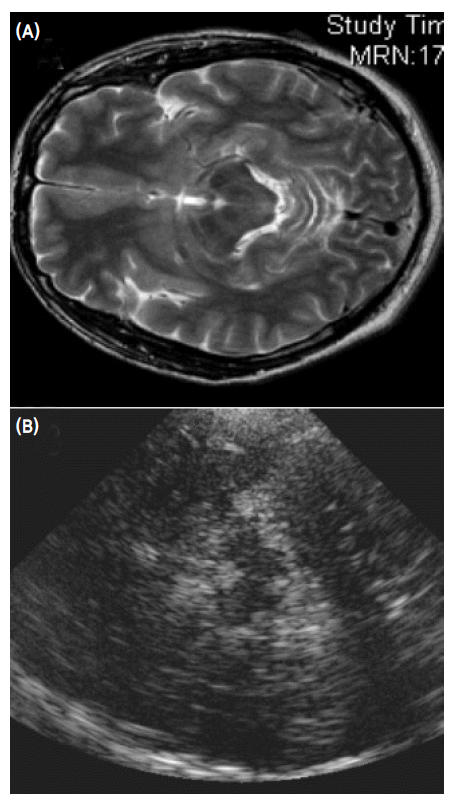
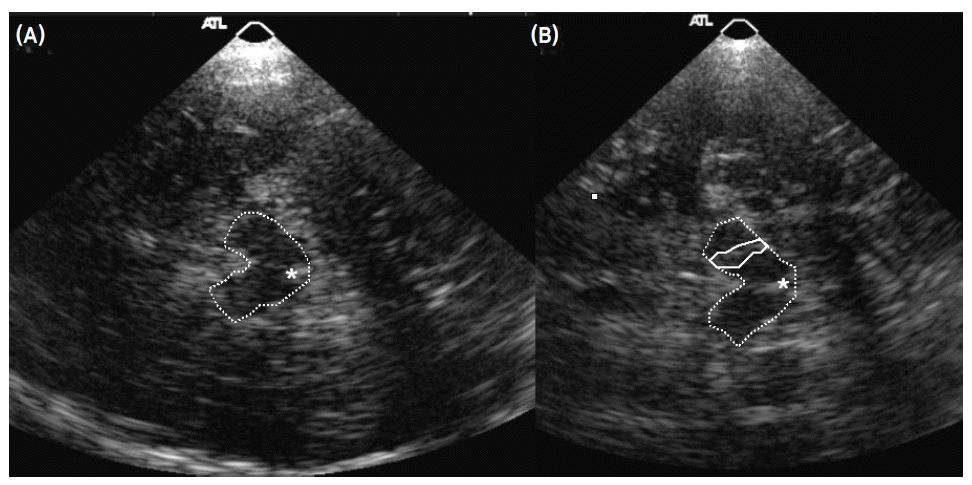
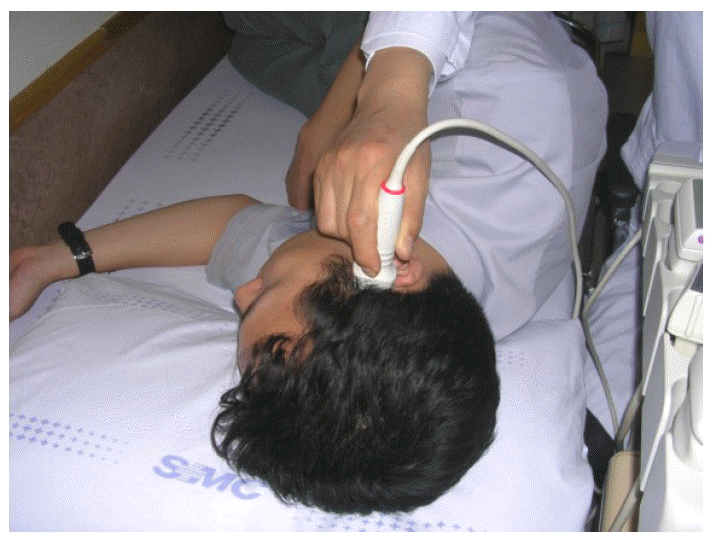
- Becker에 의해 처음으로 시도되어 개발된 중뇌 TCS 방법은 color-coded Duplex 초음파기기를 사용하는데 transducer는 2.0-2.5 MHz phased array를 사용한다.1 이때 2.0-2.5 MHz의 저주파를 사용하는 이유는 초음파가 측두골(temporal bone)을 쉽게 통과하기 위함이다. 초음파 투과 깊이는 16 cm로 맞추고 dynamic range는 45-50 dB로 고정한다. TCS probe는 귀의 약간 앞쪽 위에 위치한 관자놀이 부위에 대고 검사를 시행하는데 probe를 평행으로 유지하는 경우 보고자 하는 중뇌위치를 투사할 수 있게 된다(Fig. 1). 이형 파킨슨증후군을 감별하기 위해 수정체핵(lentiform nucleus)를 투사하기 위해서는 probe를 약간 들어서 시행하면 된다(Fig. 1).13 TCS probe를 평행하게 유지하면서 투사되는 영상을 관찰하면 그림 2에서 보는 바와 같이 하얗게 투영되는 기저수조(basal cistern)에 둘러싸여 있는 나비모양의 중뇌를 관찰할 수 있다. 나비모양의 중뇌를 좀 더 자세히 관찰하면 중앙을 가르는 hyperechogenic한 구조물인 뇌간솔기(brainstem raphe)와 중앙 뒤쪽에 위치한 수관(aqueduct)을 발견하게 된다(Fig. 3-A). 정상인 중뇌소견과는 달리 파킨슨병 환자에서는 흑질 부위에 반향성이 증가되어 있는 소견을 관찰할 수 있으며1,13,14 우리나라 파킨슨병 환자에서도 확인할 수 있었다(Fig. 3-B).15
- 파킨슨병 환자에서의 흑질의 hyperechogenicity 정도를 정량적으로 분석하는 방법으로 흑질 hyperechogenic 영역의 넓이를 재서 그 면적을 비교하거나, 면적이 0.2 cm2를 넘는 경우 반향성이 증가된 것으로 정의하여 민감도(sensitivity) 및 특이도(specificity)를 비교하게 된다. 여기서 0.2 cm2는 종전의 연구에 의해 정해진 정상과 이상을 가르는 공인된 수치이다.3,5,10 파킨슨병에서 흑질의 반향성의 정도는 초기 연구에서 파킨슨 증상의 정도와 연관성이 있다는 보고가 있었으나,3 그 이후의 보고에서는 증상의 정도와 연관성이 없다는 보고가 주류를 이루고 있다.5,16 또한 Spiegel 등의 연구에 의하면 FP-CIT SPECT 연구를 통해 도파민세포의 퇴행을 반영하는 CIT 수용(uptake) 정도와 중뇌 hyperechogenicity와 연관성이 없다는 결과가 나왔는데17 이 소견은 파킨슨병의 도파민세포의 퇴행 기전과 중뇌 흑질의 hyperechogenicity의 발생기전이 다른 메커니즘을 가지고 있다는 기존의 연구와 일치하는 소견이다. 하지만 파킨슨병 환자의 친척을 대상으로 시행한 TCS 연구에서 TCS에서 hyperechogenicity를 보인 친척에서 Fluoro-Dopa uptake가 증가된 소견을 관찰할 수 있었다고 보고하였다.6 이 결과는 TCS가 전임상기(preclinicalstage)에서도 이상을 발견할 수 있다는 가능성을 시사하고 있다.
- 흑질의 hyperechogenicity는 파킨슨병의 특수한 생물화학적 변화에 기인하는데 흑질 내 철분이 증가하거나,2,4,9 ferritin의 감소 및 neuromelanin 양의 감소에 의한 것으로 인식되고 있다.18 하지만 정상인에게서도 8-10%에서 hyperechogenicity가 관찰되는데,2,4 이 수치는 정상인이 PD로 발전할 수 있는 가능성보다는 매우 높은 수치로서 가양성(false positive)에 해당한다. 하지만 TCS 연구의 선두 주자인 Berg는 이 수치가 신경병리학적으로 증상 전(presymptomatic) 파킨슨병에 해당하는 환자군에서 파킨슨병으로 발현될 수 있는 예상 수치19와 비슷하다고 주장하고 있다. 최근 연구에서 유전성 파킨슨병인 alpha-synuclein, LRRK2, parkin, PINK1 및 DJ-1 환자를 대상으로 시행한 TCS 연구에서 이러한 유전성 파킨슨병 환자에서 산발성(sporadic) 파킨슨병에 비해 hyperechogenicity 정도가 적게 나오는 것으로 보고 하였다.20 이 연구결과는 유전성 파킨슨병에서는 철 축적이 병태생리에 비교적 적게 영향을 미치는 것이라고 해석될 수 있다.
- 이런 다양한 연구결과를 토대로 파킨슨병에서의 TCS는 안전하고, 쉽게 시행할 수 있는 좋은 진단 방법이 될 수 있으나 TCS 연구가 유럽인을 대상으로 이뤄졌고 아시아인 특히 한국인에게는 시행되지 않았다는 문제가 있었다. 그러므로 우리나라에서 파킨슨병 진단에서의 TCS의 유용성을 분석할 필요성이 생기게 되었다. 이에 본 저자 등은 국내 정상인과 파킨슨병 환자를 대상으로 TCS 연구를 시행하였다.
- 2. 한국인에서의 경두개 초음파검사 연구
- 본 저자는 한국인 파킨슨병 환자의 진단에 있어 TCS의 유용성을 확인하고 임상양상 및 심한 정도에 따라 초음파 소견에 차이가 있는 지를 분석하기 위해 UK Parkinson’s Disease Society Brain Bank 진단기준21에 합당한 43명의 파킨슨병 환자와 신경학적 이상소견이 없는 35명의 정상 대조군을 대상으로 TCS를 시행하였다. 환자의 파킨슨 증상 정도를 판정하기 위해 12시간 동안 약을 끊고 난 후 Unified Parkinson’s Disease Rating Scale (UPDRS) part III22와 Hoehn and Yahr Stage (H-Y stage)23를 측정하였다. TCS 검사방법은 Becker 등이 제시한 방법과 동일하게 transducer는 2.0에서 2.5 MHz phased array (HDI 5000, SonoCT; Philips)를 사용하여 초음파 투과 깊이를 16 cm로 맞추고 dynamic range는 45-50 dB로 고정하였다.1,15 피험자를 침대에 옆으로 눕힌 후 귀 위, 앞부분인 관자놀이 부분에 probe를 대고 측정하였다(Fig. 4). TCS 검사는 환자의 임상 정보를 모르는 영상의학과 전문의가 시행하였다. TCS 시행하면서 가장 적절한 영상을 포착하여 저장매체에 저장하였다. 이 저장된 중뇌 TCS 영상을 환자의 임상정보를 모르는 또 다른 연구자가 분석하여 중뇌 전체의 넓이와 hyperechogenic한 영역의 넓이를 측정하였다. 총 78명의 피험자 중에서 16명의 피험자(21%)에서 초음파 영상을 제대로 얻지 못하였는데 주로 나이 많은 여성 피험자에서 중뇌 초음파 영상을 얻지 못하였다. 이 결과는 아마도 노년 여성에서 많은 골다공증으로 인해 초음파가 측두골을 투사하지 못했기 때문으로 추정된다.15,24
- 연구 결과 양측의 흑질 hyperechogenicity를 보인 영역의 넓이가 파킨슨병 환자에서 정상 대조군에 비해 통계학적으로 유의하게 커져있는 소견을 보였다(0.68±0.43 and 0.05±0.19 cm2, respectively, p<0.01). 전체 중뇌 면적 대비 흑질 hyperechogenicity를 보인 영역의 넓이의 비 또한 파킨슨병 환자군에서 증가되어 있는 소견을 보였다(0.15±0.09 and 0.02±0.04, respectively, p<0.01) (Table 1). 하지만 hyperechogenicity 영역의 크기와 파킨슨병 환자의 나이, 발병연령, HY stage, UPDRS III scores는 비례하지 않았다. 파킨슨병의 주 증상에 따라 tremor-dominant, akinetic-rigid, and mixed type으로 나눠 분석한 결과도 각 비교군 간의 차이는 발견할 수 없었다(p>0.05) (Table 1). Cut-off value를 흑질 echogenic 부위의 크기 0.2 cm2로 산정하여 분석한 결과 TCS의 민감도는 82.9%, 특이도는 92.6%로 측정되었다.
- 한국인을 대상으로 한 이 연구의 결과는 기존의 TCS 연구와 동일하게 진단적 가치가 있는 것으로 확인되었고, 파킨슨 증상의 중등도와 비례하지 않은 결과를 보였다.5,16,17 하지만 Walter 등의 최근 연구25와는 달리 본 국내 연구에서는 파킨슨병 증상에 따른(tremor vs. akinetic-rigidity) TCS 소견의 차이는 없게 나왔다. 이는 본 연구에서 tremor-dominant 피험자가 수가 5명으로 적은 수였기 때문에 통계적 차이를 밝힐 수 없었던 것으로 추정된다.
- 3. 파킨슨병 이외 분야에서의 경두개 초음파검사
- 앞에서 언급한 파킨슨병 영역에서의 TCS 연구가 활발하게 진행됨과 동시에 이형 파킨슨증후군의 감별 진단에 TCS가 유용하게 사용될 수 있다는 연구가 발표되었다. Walter 등이 시행한 연구에서 파킨슨병, 다계통위축증(multiple system atrophy), 진행성 핵상마비(progressive supranuclear palsy)를 감별하기 위해 중뇌 부위뿐만 아니라 기저핵 부위인 수정체핵(lentiform nucleus) 부위를 투영함으로써 감별진단에 유의한 결과를 얻었다고 보고하였다.10 이러한 소견은 Behnke 등이 시행한 연구에서도 동일한 소견을 보여 TCS가 이형 파킨슨증후군을 감별하는데 유용한 검사도구로 사용될 가능성을 시사하고 있다.9 또한 최근 시행된 TCS 연구에서 혈관성 파킨슨증후군을 감별하는데 중뇌 TCS가 유용하다는 연구결과를 보고하고 있다.26 파킨슨-치매 증후군에 속하는 두 질환인 dementia with Lewy bodies (DLB)와 Parkinson’s disease with dementia (PDD)를 감별하는데도 도움이 된다는 최근보고도 있어 TCS의 진단적 유용성이 넓어지고 있는 실정이다.27
- 이러한 파킨슨증 영역 이외에도 파킨슨증에 동반되거나 독자적으로 발생되는 다양한 질환의 진단적 도구로도 TCS가 사용될 수 있다는 여러 연구가 속속 보고되고 있다.
- Schmidauer 등의 하지불안증(restless leg syndrome) 환자 20명을 대상으로 한 TCS 연구에서 흑질 부위의 반향성이 오히려 감소되는 소견을 관찰하였다.28 이는 하지불안증의 병태기전인 흑질 철분 부족에 기인한 것으로 해석하고 있다. 그 후에 시행된 다른 연구에서도 같은 결과를 얻었다.29 파킨슨병에서 동반되는 자율신경장애 증상 중 하나인 과민방광증(overactive bladder)는 쎄로토닌계(serotonergic) 신경조직인 기저핵솔기(brainstem raphe)의 장애로 인한 것으로 추정된다. 이러한 근거를 토대로 Walter 등은 파킨슨병 환자 중 과민방광증을 보인 환자를 대상으로 TCS를 시행하여 brainstem raphe 위치에 반향성이 감소되어 있는 소견을 보고하였다.30 뿐만 아니라, 최근 연구에 의하면 우울증 환자에서도 파킨슨병과 유사한 흑질 hyperechogenicity가 관찰되고 과민방광증에서와 유사하게 brainstem raphe 위치에 반향성이 감소되어 있는 소견을 보고하였다.31
- 근긴장이상증(dystonia) 환자의 감별진단에도 TCS의 유용성이 보고되고 있다. 1990년도 후반기에 Naumann에 의해 진행된 연구에 의하면 사경증(spasmodic torticollis)을 포함한 근긴장이상증 환자의 lentiform nucleus에서 hyperechogenicity가 증가된 소견을 보고한 바 있다.32,33 근긴장이상증 이외에도 임상적으로 감별진단이 쉽지 않은 조기발병 파킨슨병(early-onset PD)과 dopa-responsive dystonia (DRD)를 감별하는 데에도 TCS가 사용될 수 있다는 보고가 있다.34 또한 윌슨병(Wilson’s disease) 진단을 위해서 이형 파킨슨병, 근긴장이상증 진단 때와 마찬가지로 기저핵 부위를 투영하는 방법으로 감별하는 연구가 보고되었다.35 척수소뇌실조증 제3형(spinocerebellar ataxia type 3)의 진단에도 TCS가 도움이 될 수 있다는 연구결과가 나오고 있다.36
- 본태성 떨림(essential tremor; ET)에서 파킨슨병으로 발전할 가능성이 높다라는 기존의 연구결과를 토대로 44명의 ET 환자, 100명의 정상 대조군과 100명의 파킨슨병 환자를 대상으로 한 연구에서 정상군에서는 중뇌 hyperechogenicity가 3%인데 반해, ET 환자에서는 16%, 파킨슨병 환자에서는 75%에서 발견되었다고 보고하였다.37 이 연구 결과는 ET가 파킨슨병으로 진행될 위험성을 간접적으로 제시함과 동시에 ET와 파킨슨병을 감별하는데 TCS의 유용성에 있어서 제한점이 있다는 것을 시사한다.
- 이상의 문헌 고찰에서 비 파킨슨병 영역에서의 TCS의 진단적 유용성도 점점 확대되고 있음을 알 수 있다.
대상과 방법
- 지금까지 보고된 여러 문헌 고찰을 통해 TCS는 파킨슨병의 진단을 위한 간편하고, 안전한 진단 도구가 될 수 있다는 것을 알 수 있다. 초기 감별진단의 한계, 진정한 맹검(blind study)이 되지 않는 다는 점, 높은 가양성(false positive) 등의 TCS가 가지고 있는 부정적 시각이 있는 것은 사실이지만 진단적 기술의 발달로 파킨슨병 영역뿐만 아니라 이형 파킨슨증후군, 혈관성 파킨슨증후군, 파킨슨-피매 증후군, 근긴장이상증, 우울증, 하지불안증, 과민방광증 등의 다양한 질환에서도 유용하게 사용될 가능성이 제시되고 있다. 또한 본 저자 등의 한국인을 대상으로 한 TCS 연구를 통해 한국인 파킨슨병의 진단에도 TCS가 유용하게 사용될 수 있음을 확인할 수 있었다. 더 다양한 연구를 바탕으로 좀 더 표준화된 기술의 개발과 다양한 파킨슨증에서의 진단적 가치에 대한 연구가 필요하리라 사료된다.
결 론
NA; not applicable, TCS; transcranial sonography, Contralat. TCS; TCS contralateral to the clinically more affected body side, Ipsilat. TCS; TCS ipsilateral to the clinically more affected body side, SN; substantia nigra, SN hyperecho/midbrain ratio; ratio of SN hyperechogenic area to whole midbrain area.
p<0.01, compared to PD group by Mann-Whitney and Fisher’s exact test.
- 1. Becker G, Seufert J, Bogdahn U, Reichmann H, Reiners K. Degeneration of substantia nigra in chronic Parkinson’s disease visualized by transcranial color-coded real-time sonography. Neurology 1995;45:182–184.ArticlePubMed
- 2. Berg D, Becker G, Zeiler B, Tucha O, Hofmann E, Preier M, et al. Vulnerability of the nigrostriatal system as detected by transcranial ultrasound. Neurology 1999;53:1026–1031.ArticlePubMed
- 3. Berg D, Siefker C, Becker G. Echogenicity of the substantia nigra in Parkinson’s disease and its relation to clinical findings. J Neurol 2001;248:684–689.ArticlePubMed
- 4. Berg D, Roggendorf W, Schroder U, Klein R, Tatschner T, Benz P, et al. Echogenicity of the substantia nigra: association with increased iron content and marker for susceptibility to nigrostriatal injury. Arch Neurol 2002;59:999–1005.ArticlePubMed
- 5. Berg D, Merz B, Reiners K, Naumann M, Becker G. Five-year follow-up study of hyperechogenicity of the substantia nigra in Parkinson’s disease. Mov Disord 2005;20:383–385.ArticlePubMed
- 6. Ruprecht-Dorfler P, Berg D, Tucha O, Benz P, Meier-Meitinger M, Alders GL, et al. Echogenicity of the substantia nigra in relatives of patients with sporadic Parkinson’s disease. Neuroimage 2003;18:416–422.ArticlePubMed
- 7. Walter U, Wittstock M, Benecke R, Dressler D. Substantia nigra echogenicity is normal in non-extrapyramidal cerebral disorders but increased in Parkinson’s disease. J Neural Transm 2002;109:191–196.ArticlePubMed
- 8. Zedde M, Manca A, Baule G, Agnetti V. Brain parenchyma sonography (BPS) of substantia nigra (SN) in Parkinson’s disease. Parkinson & Rel Dis 2005;11(Suppl 2):222.
- 9. Behnke S, Berg D, Naumann M, Becker G. Differentiation of Parkinson’s disease and atypical parkinsonian syndromes by transcranial ultrasound. J Neurol Neurosurg Psychiatry 2005;76:423–425.ArticlePubMedPMC
- 10. Walter U, Niehaus L, Probst T, Benecke R, Meyer BU, Dressler D. Brain parenchyma sonography discriminates Parkinson’s disease and atypical parkinsonian syndromes. Neurology 2003;60:74–77.ArticlePubMed
- 11. Walter U, Dressler D, Wolters A, Probst T, Grossmann A, Benecke R. Sonographic discrimination of corticobasal degeneration vs progressive supranuclear palsy. Neurology 2004;63:504–509.ArticlePubMed
- 12. Prestel J, Schweitzer KJ, Hofer A, Gasser T, Berg D. Predictive value of transcranial sonography in the diagnosis of Parkinson’s disease. Mov Disord 2006;21:1763–1765.ArticlePubMed
- 13. Berg D, Becker G. Perspectives of B-mode transcranial ultrasound. Neuroimage 2002;15:463–473.ArticlePubMed
- 14. Becker G, Berg D. Neuroimaging in basal ganglia disorders: perspectives for transcranial ultrasound. Mov Disord 2001;16:23–32.ArticlePubMed
- 15. Kim JY, Kim ST, Jeon SH, Lee WY. Midbrain Transcranial Sonography in Korean Patients with Parkinson’s Disease. Mov Disord 2007;22:1922–1926.ArticlePubMed
- 16. Schweitzer KJ, Hilker R, Walter U, Burghaus L, Berg D. Substantia nigra hyperechogenicity as a marker of predisposition and slower progression in Parkinson’s disease. Mov Disord 2006;21:94–98.ArticlePubMed
- 17. Spiegel J, Hellwig D, Mollers MO, Behnke S, Jost W, Fassbender K, et al. Transcranial sonography and [123I] FP-CIT SPECT disclose complementary aspects of Parkinson’s disease. Brain 2006;129:1188–1193.ArticlePubMedPDF
- 18. Zecca L, Berg D, Arzberger T, Ruprecht P, Rausch WD, Musicco M, et al. In vivo detection of iron and neuromelanin by transcranial sonography: a new approach for early detection of substantia nigra damage. Mov Disord 2005;20:1278–1285.ArticlePubMed
- 19. Fearnley JM, Lees AJ. Ageing and Parkinson’s disease: substantia nigra regional selectivity. Brain 1991;114:2283–2301.ArticlePubMedPDF
- 20. Schweitzer KJ, Brussel T, Leitner P, Kruger R, Bauer P, Woitalla D, et al. Transcranial ultrasound in different monogenetic subtypes of Parkinson’s disease. J Neurol 2007;254:613–616.ArticlePubMed
- 21. Hughes AJ, Daniel SE, Kilford L, Lees AJ. Accuracy of clinical diagnosis of idiopathic Parkinson’s disease: a clinico-pathological study of 100 cases. J Neurol Neurosurg Psychiatry 1992;55:181–184.ArticlePubMedPMC
- 22. Fahn S, Elton RL; members of the UPDRS Development Committee. The unified Parkinson’s disease rating scale. In: Fahn S, Marsden CD, Calne DB, Goldstein M, editors. Recent developments in Parkinson’s disease. Vol 2:FlorhamPark, New Jersey: Macmillan Healthcare Information; 1987:153–163.
- 23. Hoehn MM, Yahr MD. Parkinsonism: onset, progression and mortality. Neurology 1967;17:427–442.ArticlePubMed
- 24. Hershkovitz I, Greenwald C, Rothschild BM, Latimer B, Dutour O, Jellema LM, et al. Hyperostosis frontalis interna: an anthropological perspective. Am J Phys Anthropol 1999;109:303–325.ArticlePubMed
- 25. Walter U, Dressler D, Wolters A, Wittstock M, Benecke R. Transcranial brain sonography findings in clinical subgroups of idiopathic Parkinson’s disease. Mov Disord 2007;22:48–54.ArticlePubMed
- 26. Tsai CF, Wu RM, Huang YW, Chen LL, Yip PK, Jeng JS. Transcranial color-coded sonography helps differentiation between idiopathic Parkinson’s disease and vascular parkinsonism. J Neurol 2007;254:501–507.ArticlePubMed
- 27. Walter U, Dressler D, Wolters A, Wittstock M, Greim B, Benecke R. Sonographic discrimination of dementia with Lewy bodies and Parkinson’s disease with dementia. J Neurol 2006;253:448–454.ArticlePubMed
- 28. Schmidauer C, Sojer M, Seppi K, Stockner H, Hogl B, Biedermann B, et al. Transcranial ultrasound shows nigral hypoechogenicity in restless legs syndrome. Ann Neurol 2005;58:630–634.ArticlePubMed
- 29. Godau J, Schweitzer KJ, Liepelt I, Gerloff C, Berg D. Substantia nigra hypoechogenicity: definition and findings in restless legs syndrome. Mov Disord 2007;22:187–192.ArticlePubMed
- 30. Walter U, Dressler D, Wolters A, Wittstock M, Benecke R. Overactive bladder in Parkinson’s disease: alteration of brainstem raphe detected by transcranial sonography. Eur J Neurol 2006;13:1291–1297.ArticlePubMed
- 31. Walter U, Hoeppner J, Prudente-Morrissey L, Horowski S, Herpertz SC, Benecke R. Parkinson’s disease-like midbrain sonography abnormalities are frequent in depressive disorders. Brain 2007;130:1799–1807.ArticlePubMedPDF
- 32. Naumann M, Becker G, Toyka KV, Supprian T, Reiners K. Lenticular nucleus lesion in idiopathic dystonia detected by transcranial sonography. Neurology 1996;47:1284–1290.ArticlePubMed
- 33. Becker G, Naumann M, Scheubeck M, Hofmann E, Deimling M, Lindner A, et al. Comparison of transcranial sonography, magnetic resonance imaging, and single photon emission computed tomography findings in idiopathic spasmodic torticollis. Mov Disord 1997;12:79–88.ArticlePubMed
- 34. Hagenah JM, Hedrich K, Becker B, Pramstaller PP, Seidel G, Klein C. Distinguishing early-onset PD from doparesponsive dystonia with transcranial sonography. Neurology 2006;66:1951–1952.ArticlePubMed
- 35. Walter U, Krolikowski K, Tarnacka B, Benecke R, Czlonkowska A, Dressler D. Sonographic detection of basal ganglia lesions in asymptomatic and symptomatic Wilson disease. Neurology 2005;64:1726–1732.ArticlePubMed
- 36. Postert T, Eyding J, Berg D, Przuntek H, Becker G, Finger M, et al. Transcranial sonography in spinocerebellar ataxia type 3. J Neural Transm Suppl 2004;(68):123–133.ArticlePubMed
- 37. Stockner H, Sojer M, K KS, Mueller J, Wenning GK, Schmidauer C, et al. Midbrain sonography in patients with essential tremor. Mov Disord 2007;22:414–417.ArticlePubMed
REFERENCES
Figure & Data
References
Citations

- Validity and sensitivity of instrumented postural and gait assessment using low-cost devices in Parkinson’s disease
Ignacio Álvarez, Jorge Latorre, Miquel Aguilar, Pau Pastor, Roberto Llorens
Journal of NeuroEngineering and Rehabilitation.2020;[Epub] CrossRef
Comments on this article
- Figure
- Related articles
-
- Comparative Olfactory Profiles in Parkinson’s Disease and Drug-Induced Parkinsonism
- Apomorphine Monotherapy for Parkinson’s Disease: A Neglected Option?
- Fecal Calprotectin in Parkinson’s Disease and Multiple System Atrophy
- The Supplementary Motor Complex in Parkinson’s Disease
- Association of AXIN1 With Parkinson’s Disease in a Taiwanese Population
 KMDS
KMDS
 E-submission
E-submission
 PubReader
PubReader ePub Link
ePub Link Cite
Cite